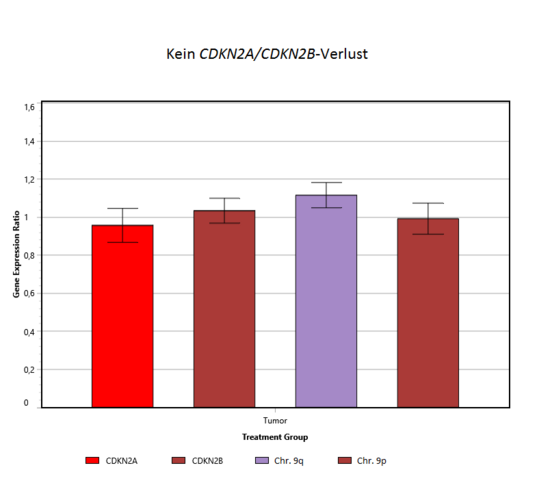
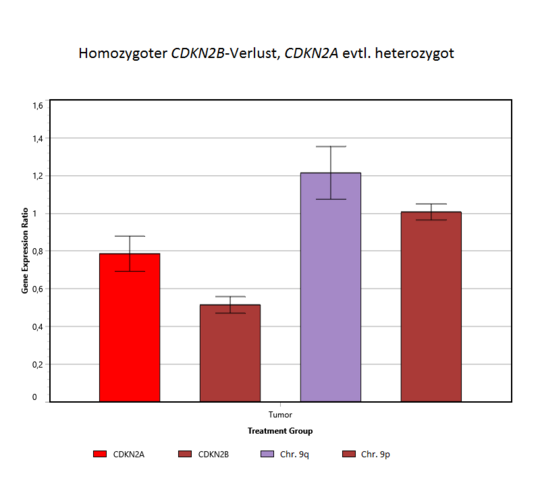
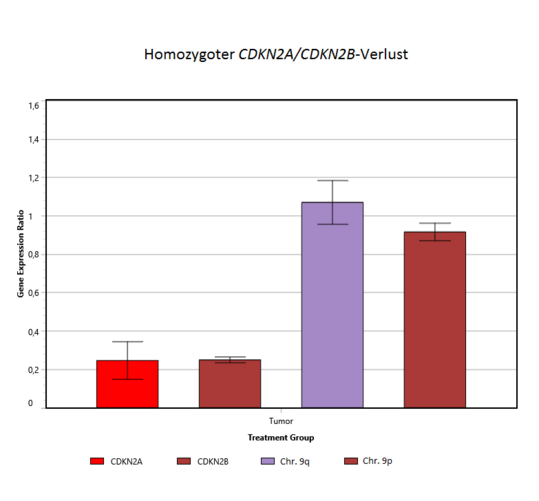
Homozygote CDKN2A-/CDKN2B-Deletion
Neuropathologische Diagnostik am UKS
High-grade-Marker bei Gliomen und Meningeomen
Bei verschiedenen Tumoren korrelieren kürzere Überlebenszeiten mit homozygoten Verlusten des Chromosomenabschnitts 9p21. Auf diesem Abschnitt liegen unter anderem der CDKN2A- und CDKN2B-Lokus, der Cyclin-abhängige Kinaseinhibitoren kodiert (1). Die Proteine p16 und p14 (CDKN2A), sowie p15 (CDKN2B) bilden Komplexe mit CDK4 und/oder CDK6 und regulieren den Zellzyklus unter anderem durch eine Inhibierung des Rb/E2F-Signalwegs [2, 3]. P14 dient darüber hinaus als Stabilisator des Tumorsupressorproteins p53 und nimmt darüber zusätzlich Einfluss auf den Zellzyklus [3].
Die diagnostische Bedeutung homozygoter CDKN2A- und CDKN2B-Deletionen liegt gemäß der aktuellen 5. Edition der WHO-Klassifikation der Hirntumore [4] darin, dass diese Deletionen bei IDH-mutierten Astrozytomen einen WHO-Grad 4 definieren, bei Oligodendrogliomen ein Malignitätszeichen sind, das einen WHO-Grad 3 definiert und bei Meningeomen ein malignes Meningeom WHO Grad 3 definiert.
Die Bestimmung des CDKN2A- und CDKN2B-Status erfolgt mittels quantitativer PCR. Mit Hilfe von Vollblut-DNA oder Referenzgewebe-DNA und nicht-betroffenen Referenzgenloki lassen sich so Kopienzahlveränderungen im Tumor feststellen [5,6]. Sowohl in der Referenz-DNA als auch in der Tumor-DNA werden die Cq-Werte (ein quantitatives Maß für das Vorhandensein des Genabschnittes) der Gene CDKN2A, CDKN2B (Chromosom 9p21.3), zwei weiterer Gene auf 9p und 9q, sowie von β-Actin und B2M ermittelt. Die letzteren beiden (β-Actin und B2M) dienen dabei als probeninterne Referenzen (ΔCq zwischen Gene of Interest und Reference Gene), um Qualitäts- und Mengenunterschiede der DNA herausrechnen zu können. Für mögliche heterozygote oder homozygote Deletionen, hervorgerufen durch somatische Veränderungen im Tumor (die nicht im Blut vorhanden sind), wird die Differenz der Cq-Werte zwischen Tumor- und Blutprobe bestimmt (ΔΔCq). Liegt das relative Verhältnis der CDKN2-Gene in Tumor/Blut etwa um 1,0, liegt kein Verlust vor. Liegt der Wert darunter, kann – je nach Tumorzellanteil – eine heterozygote oder homozygote CDKN2A/2B-Deletion vorliegen. Mit Hilfe weiterer Gene auf Chromosom 9 wird beurteilt, ob es sich um punktuelle Deletionen oder um größere chromosomale Verluste handelt.
Literatur:
[1] Shirahata et al. (2018) Novel, improved grading system(s) for IDH‑mutant astrocytic gliomas. Acta Neuropathologica 136:153–166
[2] Reis GF, Pekmezci M, Hansen HM, Rice T, Marshall RE, Molinaro AM, Phillips JJ, Vogel H, Wiencke JK, Wrensch MR, Walsh KM, Perry A. CDKN2A loss is associated with shortened overall survival in lower-grade (World Health Organization Grades II-III) astrocytomas. J Neuropathol Exp Neurol. 2015 May;74(5):442-52. doi: 10.1097/NEN.0000000000000188. PMID: 25853694;PMCID: PMC4397174Rolle von CDKN2A und CDKN2B
[3] Huang LE. Impact of CDKN2A/B Homozygous Deletion on the Prognosis and Biology of IDH-Mutant Glioma. Biomedicines. 2022 Jan 24;10(2):246. doi: 10.3390/biomedicines10020246. PMID: 35203456; PMCID: PMC8869746.
[4] WHO Classification of Tumours, 5th Edition. Central Nervous System Tumours, Volume 6. WHO Classification of Tumours Editorial Board.ISBN-13 978-92-832-4508-7
[5] Ma und Chung (2015) Quantitative Analysis of Copy Number Variants Based on Real-Time LightCycler PCR. Curr Protoc Hum Genet. ; 80: 7.21.1–7.21.8
[6] Wilke et al. (2000) Diagnosis of Haploidy and Triploidy Based on Measurement of Gene Copy Number by Real-Time PCR. HUMAN MUTATION 16:431-436
Abbildung: Quantitative Bestimmung des CDKN2A-/CDKN2B-Deletionsstatus. Aus dem Verhältnis von Referenzgenen und den Zielgenen (CDKN2A und CDKN2B) aus Tumor und Blut wird bestimmt, ob Genverluste vorliegen. Bei einem Verhältnis von 1 liegen keine Verluste vor (links), sind die Werte deutlich erniedrigt, ist der Tumor von einem homozygoten Verlust betroffen (rechts). CDKN2A und CDKN2B können auch in unterschiedlicher Weise betroffen sein, z.B. durch einen ausgeprägteren CDKN2B-Verlust (Mitte).